Nowe spojrzenie na choroby neurodegeneracyjne: problem starzenia się mózgu, a nie „błędnych genów”
W świecie nauki pojawiły się przełomowe informacje dotyczące chorób neurodegeneracyjnych, takich jak Alzheimer czy Parkinson. Okazuje się, że to nie „błędne geny” są głównym czynnikiem sprawczym, ale pogarszająca się z wiekiem zdolność mózgu do usuwania szkodliwych białek. Odkrycie to otwiera nowe możliwości w zakresie wczesnego diagnozowania oraz bardziej skutecznego leczenia tych wyniszczających schorzeń.
Dlaczego nasz mózg przestaje sobie radzić?
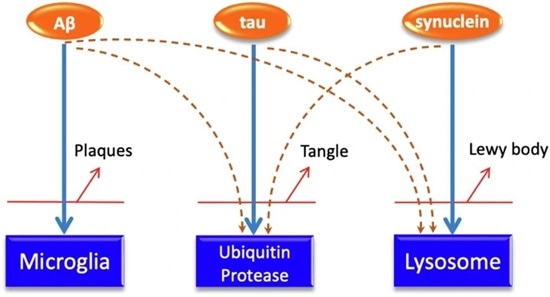
Choroby neurodegeneracyjne są wynikiem postępującego uszkodzenia komórek nerwowych, którego główną przyczyną jest kumulacja toksycznych białek. W zdrowym organizmie istnieją zaawansowane systemy usuwania takich białek – np. mikroglej, lizosomy czy szlak ubikwityno-proteasomowy. Jednak wraz z wiekiem ich wydajność maleje, co prowadzi do nagromadzenia amyloidu beta, białka tau czy alfa-synukleiny w mózgu. Te szkodliwe substancje zakłócają pracę neuronów, co w konsekwencji wywołuje objawy charakterystyczne dla chorób takich jak Alzheimer czy Parkinson.
Wbrew powszechnemu przekonaniu geny pełnią tu rolę bardziej pośrednią. Większość genów związanych z ryzykiem tych schorzeń wpływa na mechanizmy odpowiedzialne za usuwanie uszkodzonych białek, a nie na bezpośrednie wywoływanie choroby. Co więcej, wiele osób starszych wykazuje nakładające się patologie – obecność zarówno złogów amyloidu, splotów neurofibrylarnych, jak i ciałek Lewy’ego. Oznacza to, że różne systemy oczyszczania białek mogą wzajemnie się przeciążać, prowadząc do kaskadowych awarii w mózgu.
Znaczenie genów w świetle nowych badań
Naukowcy szczegółowo przyjrzeli się mechanizmom powstawania złogów białkowych w chorobach neurodegeneracyjnych. Ich analizy wykazały, że białka związane z tymi schorzeniami – takie jak amyloid-beta, białko tau i alfa-synukleina – pochodzą z genów intensywnie eksprymowanych w mózgu. Problemem nie jest jednak ich nadprodukcja, lecz osłabienie zdolności do ich usuwania. Kluczowe znaczenie mają tu m.in. czynniki genetyczne, takie jak duplikacje genów (np. APP, SNCA, MAPT) czy zmiany w procesach regulacji syntezy białek.
Warto również zauważyć, że zaawansowany wiek stanowi główny czynnik ryzyka. Choć genetyka odgrywa istotną rolę, to spadek wydajności procesów oczyszczania białek z wiekiem jest elementem decydującym o wystąpieniu tych chorób. Innymi słowy, geny mogą predysponować do choroby, lecz bez zaawansowanego wieku problem mógłby się nigdy nie ujawnić.
Czy można przeciwdziałać awariom układu oczyszczania białek?
Niepokojące jest to, że systemy oczyszczania białek w mózgu są ze sobą ściśle powiązane. Jeśli jeden system ulegnie przeciążeniu – na przykład mikroglej odpowiadający za usuwanie amyloidu-beta – może to obciążyć inne systemy, takie jak lizosomy usuwające alfa-synukleinę. Taki efekt domina zwiększa ryzyko równoczesnego nagromadzenia różnych toksycznych białek, co dodatkowo komplikuje diagnozę i leczenie. Jednym z przykładów tego zjawiska jest tzw. tauopatia związana z wiekiem, która może umożliwiać rozprzestrzenianie się patologii amyloidu na inne obszary mózgu.
Również geny takie jak LRRK2, związane zarówno z Parkinsonem, jak i tauopatiami, wskazują na to, że to, jak organizm radzi sobie z uszkodzeniami komórkowymi, ma kluczowe znaczenie dla ich skutków klinicznych. Należy jednak podkreślić, że wiele przypadków ma charakter wieloczynnikowy. Środowisko oraz styl życia mogą w znaczny sposób modulować ryzyko wystąpienia objawów, nawet u osób z predyspozycjami genetycznymi.
Wnioski na przyszłość
Jak pokazują badania, starzenie się samo w sobie jest główną przyczyną awarii systemów oczyszczania w mózgu. Terapie celujące w poprawę ich funkcjonowania mogą stanowić klucz do zapobiegania neurodegeneracji. Zamiast skupiać się wyłącznie na zmianach genetycznych, konieczne jest opracowanie strategii, które wzmocnią zdolność organizmu do eliminacji szkodliwych białek.
Naukowcy apelują również o bardziej szczegółowe badania, uwzględniające różnice populacyjne oraz wiekowe. Większość dotychczasowych danych pochodzi z badań przeprowadzanych na przedstawicielach populacji europejskiej, co może ograniczać ich zastosowanie w innych grupach etnicznych. Rozszerzenie badań na różne populacje i uwzględnienie biomarkerów oraz danych obrazowych mogłoby przyczynić się do wcześniejszego wykrywania osób z wysokim ryzykiem zachorowania, zanim rozwiną się pierwsze objawy kliniczne.
Podsumowując, te rewolucyjne odkrycia wskazują na potrzebę nowego podejścia do diagnozy i leczenia chorób neurodegeneracyjnych. Zamiast traktować geny jako główny problem, należy skierować uwagę na starzenie się i spadek wydajności mechanizmów oczyszczania białek. Przyszłość leczenia może leżeć w terapii skoncentrowanej na spowalnianiu tych procesów, co mogłoby znacznie poprawić jakość życia milionów ludzi na całym świecie.