Naukowcy odkrywają, jak SARS-CoV-2 przekształca metabolizm cholesterolu
Badania nad wpływem SARS-CoV-2 na organizm człowieka nieustannie dostarczają nowych informacji. Naukowcy z USA przeprowadzili eksperymenty, które rzucają światło na mechanizmy, za pomocą których wirus przekształca metabolizm lipidów w organizmie gospodarza. Szczególnym obszarem zainteresowania stał się cholesterol i jego wpływ na przebieg infekcji oraz potencjalne powikłania metaboliczne i sercowo-naczyniowe.
Wpływ SARS-CoV-2 na metabolizm cholesterolu
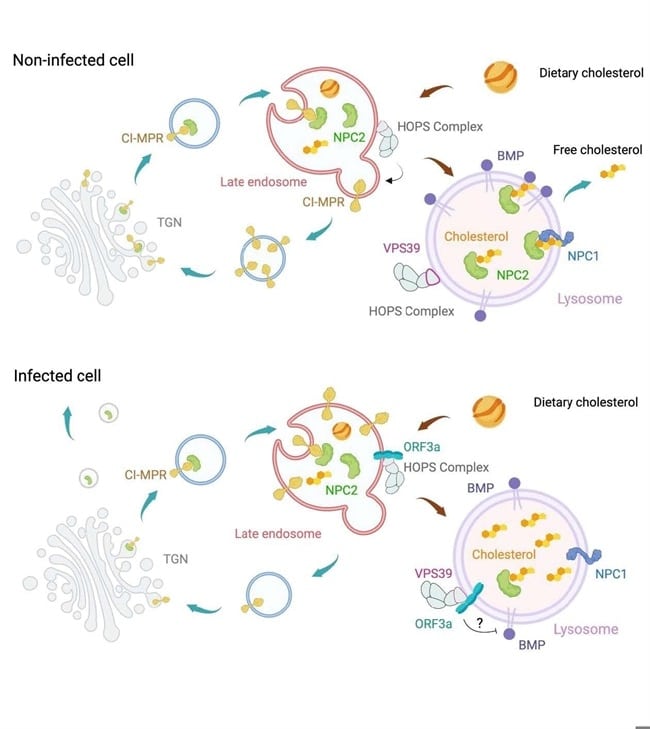
Cholesterol pełni kluczową rolę w funkcjonowaniu komórek, w tym w ich strukturze i działaniu błon komórkowych. W zdrowych komórkach jest on transportowany przez lizosomy, z pomocą białek takich jak Niemann-Pick C1 (NPC1) i Niemann-Pick C2 (NPC2). Badania wykazały, że SARS-CoV-2 wykorzystuje ten mechanizm, zakłócając szlaki transportu cholesterolu, co prowadzi do jego akumulacji w lizosomach.
Zidentyfikowano szczególny udział białka wirusa o nazwie ORF3a, które wiąże się z kluczowym białkiem gospodarza, VPS39. Taka interakcja zaburza proces przemieszczania cholesterolu i jego usuwania z lizosomów. Odkryto również, że SARS-CoV-2 obniża poziom specyficznego lipidu lizosomalnego, BMP (bis(monoacylglicerofosforan)), co dodatkowo wzmacnia zjawisko akumulacji cholesterolu.
Warto podkreślić, że mechanizm ten jest unikalny dla SARS-CoV-2, a podobne białko ORF3a w wirusie SARS-CoV (wirusie powodującym epidemię SARS w 2003 roku) nie wykazuje takiego działania.
Metody badawcze
W celu przeanalizowania wpływu SARS-CoV-2 na metabolizm cholesterolu, naukowcy zastosowali szereg zaawansowanych technik laboratoryjnych. Komórki ludzkie i zwierzęce, takie jak A549, HeLa i Vero E6, zostały zakażone wirusem SARS-CoV-2, a następnie poddano je szczegółowym analizom.
Używano zaawansowanego mikroskopu konfokalnego oraz technik takich jak immunofluorescencja i barwienie filipiną, które pozwalały na wizualizację lokalizacji cholesterolu w komórkach. Dodatkowo, do analizy lipidów zastosowano metodę chromatografii gazowej połączonej ze spektrometrią masową (GC-MS). W eksperymentach szczególną rolę odegrały również mutacje w białku ORF3a, które pozwoliły zidentyfikować krytyczne miejsca odpowiedzialne za interakcję z VPS39.
Wyniki badań
Badania wykazały, że infekcja SARS-CoV-2 prowadzi do nieprawidłowej lokalizacji cholesterolu w komórkach. Zamiast prawidłowego transportowania cholesterolu, lizosomy stawały się miejscem jego nadmiernej akumulacji. Wyniki potwierdziły, że białko ORF3a wirusa jest kluczowym czynnikiem odpowiedzialnym za te procesy.
Interakcja ORF3a z białkiem VPS39 zaburzała transport cholesterolu z lizosomów, powodując jego gromadzenie się. Co ciekawe, mutacje w dwóch kluczowych miejscach ORF3a (W193 i Y184) znacząco osłabiały tę interakcję, co sugeruje potencjalne możliwości terapeutyczne. Dodatkowo, zaobserwowano obniżenie poziomów BMP w lizosomach, co jeszcze bardziej utrudniało prawidłowy transport cholesterolu.
Znaczenie odkrycia
Wyniki badań mają daleko idące konsekwencje dla zrozumienia długoterminowych skutków zakażenia SARS-CoV-2. Zakłócenia w metabolizmie cholesterolu mogą przyczyniać się do rozwoju powikłań, takich jak dyslipidemia (zaburzenia lipidowe) czy choroby sercowo-naczyniowe, które są coraz częściej zgłaszane u osób, które przeszły COVID-19.
Co więcej, odkrycia te otwierają nowe perspektywy terapeutyczne. Interwencje mające na celu przywrócenie równowagi lipidowej w komórkach mogą stać się skutecznym sposobem na ograniczenie negatywnych skutków infekcji SARS-CoV-2. Na przykład, leki regulujące metabolizm cholesterolu lub modulujące funkcje białek takich jak ORF3a mogłyby znaleźć zastosowanie w leczeniu COVID-19 i jego powikłań.
Wnioski
Badania nad SARS-CoV-2 wciąż dostarczają nowych informacji na temat sposobów, w jakie wirus manipuluje organizmem gospodarza, aby ułatwić swoją replikację i uciec przed układem odpornościowym. Odkrycie mechanizmu związanego z akumulacją cholesterolu w lizosomach rzuca nowe światło na złożoność patogenezy COVID-19.
Zrozumienie tego mechanizmu może nie tylko pomóc w opracowaniu skuteczniejszych terapii, ale również zapobiec długoterminowym komplikacjom zdrowotnym u pacjentów po przejściu choroby. To ważny krok w walce z pandemią, który podkreśla znaczenie badań na poziomie molekularnym w kontekście zdrowia publicznego.