Jak sztuczna inteligencja zmienia diagnostykę raka piersi?
W ostatnich latach sztuczna inteligencja (AI) staje się coraz bardziej integralnym elementem medycyny, otwierając nowe możliwości w diagnostyce i terapii. Jednym z obszarów, gdzie AI odgrywa kluczową rolę, jest onkologia, a konkretnie ocena naciekających limfocytów nowotworowych (TIL) w przypadku potrójnie negatywnego raka piersi (TNBC). Badania wskazują, że modele oparte na AI znacznie przewyższają tradycyjne metody manualne pod względem precyzji, choć ich zastosowanie w praktyce klinicznej wymaga jeszcze odpowiednich walidacji na dużych i zróżnicowanych zestawach danych.
Nowoczesne podejście do oceny biomarkerów w TNBC
W kontekście wczesnego stadium raka piersi jednym z kluczowych wyzwań jest skuteczna klasyfikacja ryzyka pacjentek. Umożliwia to unikanie zarówno nadmiernego leczenia, jak i jego niedostateczności. W przypadku TNBC, liczba limfocytów naciekających zrąb guza – tzw. stromalne TIL (sTIL) – jest uznawana za ważny wskaźnik prognostyczny. Jednakże tradycyjne metody oceny sTIL są obarczone dużą zmiennością między różnymi obserwatorami, co utrudnia precyzyjne i spójne wnioski.
AI oferuje rozwiązanie tego problemu, zapewniając bardziej jednolite wyniki i możliwość głębszej analizy interakcji między nowotworem a układem odpornościowym. W praktyce klinicznej jednak kluczowym wyzwaniem pozostaje zapewnienie, że modele AI są odporne na różnice w platformach obrazowania oraz dobrze radzą sobie z danymi pochodzącymi z różnych źródeł.
Zakres i metodologia badania
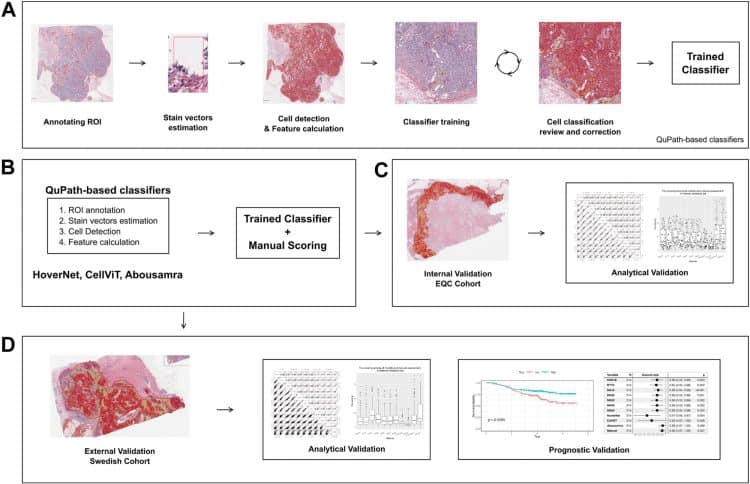
W ramach najnowszego badania naukowcy przeanalizowali skuteczność dziesięciu modeli AI w ocenie TIL w potrójnie negatywnym raku piersi. Wykorzystano próbki tkanek od 106 pacjentek z TNBC, z czego część służyła do treningu i testowania modeli, a pozostałe do walidacji zewnętrznej. Modele oparto na trzech różnych podejściach: sieciach neuronowych (NN), metodzie najbliższych sąsiadów (KNN) oraz drzewach decyzyjnych (RT). Dodatkowo, w badaniu uwzględniono zaawansowane algorytmy głębokiego uczenia, takie jak HoverNet, CellViT oraz model opracowany przez Abousamrę.
Trening modeli odbywał się na zestawach obrazów, które zawierały szczegółowe adnotacje dla około 450 komórek na obraz. Proces szkolenia obejmował iteracyjne weryfikacje przez ludzi, aby zapewnić, że modele dokładnie odzwierciedlają złożoność TIL. Wyniki cyfrowe były następnie porównywane z ocenami manualnymi patologów za pomocą współczynnika korelacji Spearmana.
Wyniki badania
Modele AI wykazały zróżnicowaną skuteczność w zależności od zastosowanej metody oraz wielkości zestawów treningowych. Przykładowo, model RT10 osiągnął najlepszą korelację z wynikami manualnymi w przypadku ograniczonych danych treningowych, podczas gdy CellViT oraz HoverNet wyróżniały się szczegółowością segmentacji komórek. Jednakże zauważono istotne różnice w wynikach uzyskanych na zestawach walidacji wewnętrznej i zewnętrznej. W szczególności, modele wykazywały słabszą wydajność w przypadku danych pochodzących z różnych platform obrazowania, co podkreśla znaczenie standaryzacji w tej dziedzinie.
W analizach prognostycznych wszystkie modele z wyjątkiem tego opracowanego przez Abousamrę wykazały istotną zdolność przewidywania przeżywalności wolnej od choroby (IDFS). Modele oparte na AI okazały się bardziej skuteczne, gdy wyniki TIL były traktowane jako ciągłe, a nie bazowały na ustalonych progach, co eliminuje wpływ różnic w dystrybucji wyników między różnymi metodami.
Znaczenie wyników i wyzwania do rozwiązania
Badanie potwierdziło, że modele AI mają potencjał, aby zrewolucjonizować ocenę TIL w TNBC, oferując bardziej precyzyjne i spójne wyniki w porównaniu do metod manualnych. Jednakże ich wdrożenie w codziennej praktyce wymaga dalszych badań, szczególnie nad poprawą wydajności na zestawach pochodzących z różnych źródeł.
Naukowcy podkreślają również znaczenie przejrzystości i wyjaśnialności modeli AI. Kluczowe jest, aby lekarze mogli zrozumieć, w jaki sposób algorytm podjął daną decyzję, oraz mieli możliwość przeglądania błędnie sklasyfikowanych komórek. Tylko takie podejście pozwoli na budowanie zaufania do technologii AI w środowisku klinicznym.
Perspektywy na przyszłość
Aby AI mogło stać się standardowym narzędziem w diagnostyce raka, konieczne jest opracowanie dużych, zróżnicowanych i wieloośrodkowych zestawów danych, które posłużą jako benchmarki do walidacji modeli. Dzięki temu można będzie wyeliminować ryzyko związane z uprzedzeniami specyficznymi dla danego modelu oraz zwiększyć jego zgodność z rzeczywistymi potrzebami klinicznymi.
Podsumowując, AI otwiera nowe możliwości w diagnostyce i terapii raka piersi, jednak droga do pełnej integracji tej technologii w praktyce klinicznej wymaga dalszych badań i inwestycji w rozwój infrastruktury danych.